發(fā)布時(shí)間:2023-11-29 人氣:1100 作者:
馬來西亞注冊概況;
注冊流程(根據(jù)MDA/GL/MD-01)
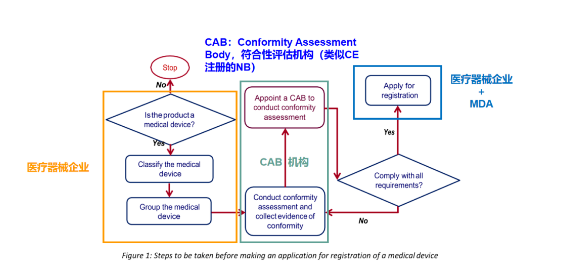
CAB的類型:產(chǎn)品 & 體系

產(chǎn)品CAB審核
根據(jù) Conformity Assessment Procedures for Medical Device Approved by Recognised Countries: 已經(jīng)在認(rèn)可國家中獲得上市許可的產(chǎn)品,可以進(jìn)行簡單產(chǎn)品CAB審核(證書+產(chǎn)品注冊文檔Verification驗(yàn)證 + QMS審核的簡單CAB審核路徑,非全流程CAB審核)
如果產(chǎn)品沒有在認(rèn)可國家中獲得上市許可,則需要進(jìn)行全流程CAB審核。
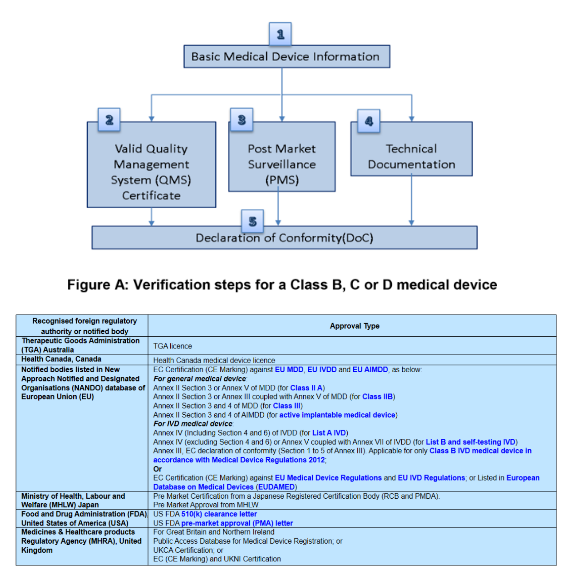
CSDT的內(nèi)容要求
Executive summary 產(chǎn)品的概況
Relevant essential principles and rule used to demonstrate conformity 相關(guān)的基本要求符合證據(jù)
Description of medical device 器械描述
Summary of design verification and validation documents 設(shè)計(jì)驗(yàn)證與確認(rèn)文件
Pre-clinical studies 臨床前研究
Software validation studies 軟件確認(rèn)
Medical devices containing biological material 含生物來源原料的器械
Clinical evidence 臨床證據(jù)
Medical device labelling 器械標(biāo)簽
Risk analysis 風(fēng)險(xiǎn)分析
當(dāng)?shù)厥跈?quán)代表要求:有GDPMD證書(新申請的當(dāng)?shù)厥跈?quán)代表的GDPMD審核費(fèi)用依據(jù)當(dāng)?shù)谻AB機(jī)構(gòu)制定各有不同;GDPMD現(xiàn)場審核排期到完成流程約1~2個(gè)月)、向MDA申請了Establishment License(授權(quán)代表MDA EL證官方收費(fèi):4000+250 RM)(當(dāng)?shù)厥跈?quán)代表收費(fèi)視具體情況而定)
注冊時(shí)間、收費(fèi)情況
MDA審核時(shí)間視情況而定,約1~6個(gè)月;B類產(chǎn)品收費(fèi):1000+250 RM;C類產(chǎn)品收費(fèi):2000+500 RM;D類產(chǎn)品收費(fèi):3000+750 RM
總體注冊時(shí)間約1~1.5年





