河北省《第二類醫(yī)療器械經(jīng)營備案憑證》核發(fā)
《醫(yī)療器械監(jiān)督管理條例》
不限 NMPA 廣東省 江蘇省 浙江省 上海市 北京市 福建省 天津市 重慶市 河北省 山西省 吉林省 遼寧省 黑龍江省 陜西省 甘肅省 青海省 山東省 臺灣省 河南省 湖北省 湖南省 江西省 安徽省 海南省 四川省 貴州省 云南省
不限 備案 首次注冊 延續(xù)注冊 生產(chǎn)許可 經(jīng)營許可 注冊人制度 注冊事項變更 許可事項變更 GMP 質(zhì)量體系輔導(dǎo) ISO 13485質(zhì)量體系 首次認(rèn)證 變更認(rèn)證 首次備案 變更注冊/備案 審批 補發(fā) 核發(fā)

《醫(yī)療器械監(jiān)督管理條例》

1、申報注冊的產(chǎn)品已經(jīng)列入《總局關(guān)于發(fā)布醫(yī)療器械分類目錄的公告》(2017年第104號)的附件《醫(yī)療器械分類目錄》,且管理類別為第二類。(注:對新研制的尚未列入分類目錄的醫(yī)療器械,申請人可以直接向國家食品藥品監(jiān)督管理總局申請第三類醫(yī)療器械產(chǎn)品注冊,也可以依據(jù)分類規(guī)則判斷產(chǎn)品類別并向國家食品藥品監(jiān)督管理總局申請類別確認(rèn)后,申請產(chǎn)品注冊或者辦理產(chǎn)品備案。)
2、申請人應(yīng)當(dāng)是在廣東省轄區(qū)范圍依法進行登記的企業(yè)(醫(yī)療器械注冊人制度試點申請人要求另行規(guī)定)。
.........


已有1251次查看

已有1086次查看

已有1008次查看

已有1071次查看
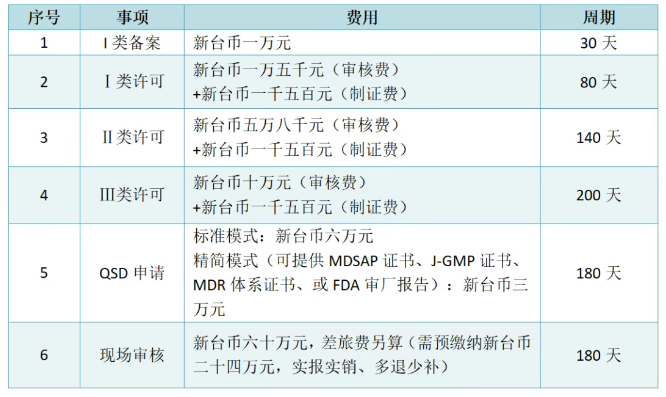
已有112次查看
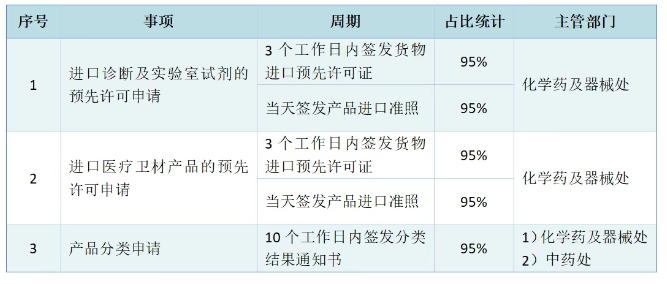
已有102次查看

已有100次查看

已有129次查看

已有113次查看

已有117次查看

已有116次查看

已有111次查看

已有109次查看

已有102次查看
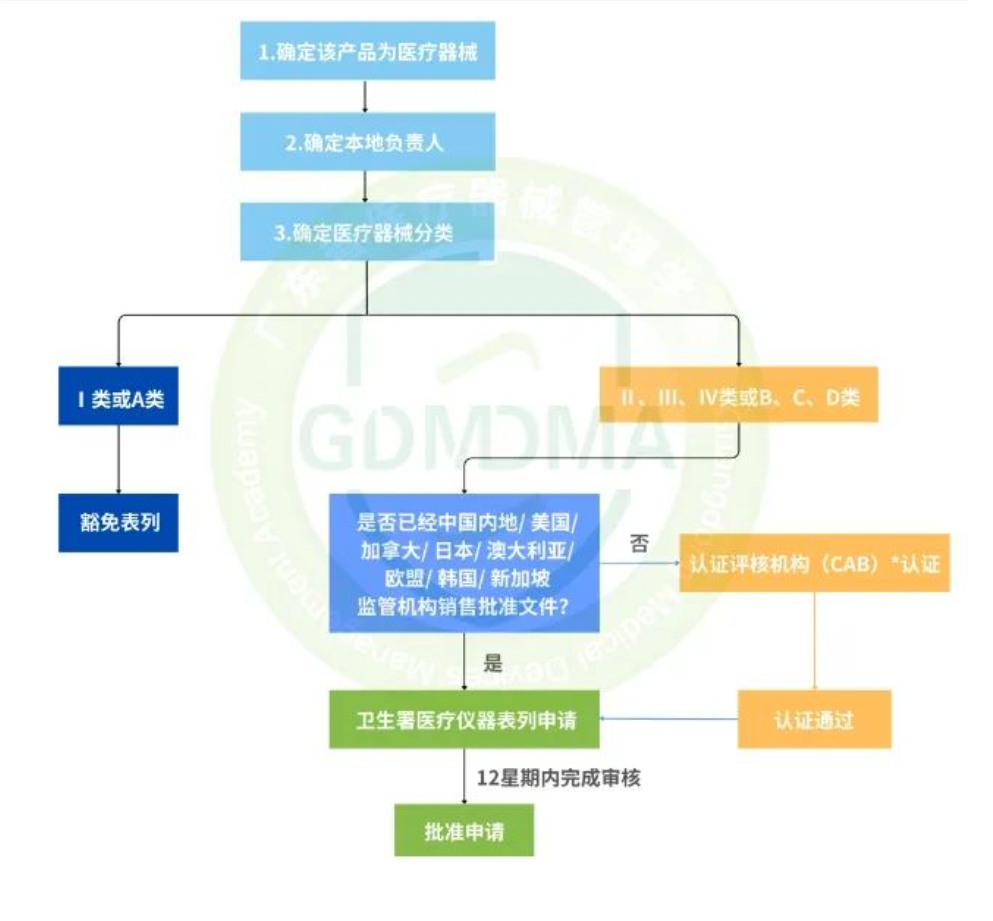
已有146次查看





