發布時間:2023-12-01 人氣:1650 作者:

官方機構/監管當局:Agência Nacional de Vigilancia Sanitária,ANVISA 國家衛生監督局
監管概況:
Market authorizations are issued by ANVISA depending on the risk classification of the medical device. Market authorizations for products categorized as Risk Class I and II do not expire, but they might be cancelled upon request, in case of reassessment, in the impossibility of solving irregularities, or when fraud is detected. Pre-market approvals for products categorized as Risk Class III and IV are valid for ten years from the date of their publication in the Brazilian Official Gazette, and may be renewed for equal and successive periods. ANVISA負責醫療器械產品的上市許可授權;I、II類產品注冊永久有效(除非被取締),III、IV類產品10年有效,可以延續注冊。
Please note that it is not possible for foreign companies to make administrative arrangements for issuing market authorizations directly with ANVISA. Foreign companies shall have partner companies legally constituted in Brazil that will be legally responsible for the products imported to and distributed in the Brazilian territory. 外國企業必須通過巴西本地企業作為進口和分銷代理,并負責與ANVISA溝通注冊。
監管法規:RDC 751/2022【2023年3月1日生效,類似MDR】、RDC 36/2015【IVD產品,將被新法規取代】
醫療器械分類及注冊管理情況:
I類,低風險
II類,中風險
III類,高風險
IV類,最高風險
分類規則在RDC 751/2022的ANEXO I部分和RDC 36/2015的Se??o II部分
生產(進口產品)商要求、產品注冊:
境外生產商首先需要指定巴西境內的代理持證人(Brazil Registration Holder (BRH)),角色包含總代、注冊代理等,直接與ANVISA溝通注冊等事宜。BRH公司具體收費(代持證書費用、進口業務費用等)自定。(BRH公司需要有ANVISA發出的Company Working Allowance許可)
BGMP(巴西GMP)要求:
III、IV類產品申請注冊前需完成BGMP審核(ANVISA根據實際情況可要求進行現場審核;包含巴西要求的MDSAP證書可用于證明滿足BGMP要求,可用于免除BGMP審核情況下申請BGMP證書)。由BRH申請BGMP審核。BGMP證書的有效期為2年。(BGMP收費約 30,000 USD)
特殊要求:
有源產品在申請注冊前需完成INMETRO認證(收費視具體認證機構而定,時間約4~6個月)
射頻、藍牙、WiFi等通訊產品在申請注冊前需完成ANATEL認證(收費視具體認證機構而定,時間約4~6個月)

注冊流程、時間及收費情況
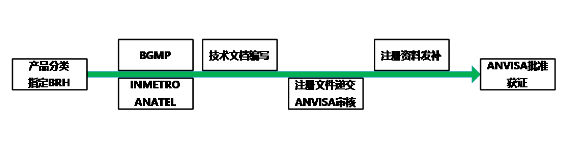
ANVISA收取注冊費用約 9,000 USD;III、IV類產品審核時間約2~6個月整體注冊時間約1~2年(BGMP排期及審核時間約8個月到1年)





