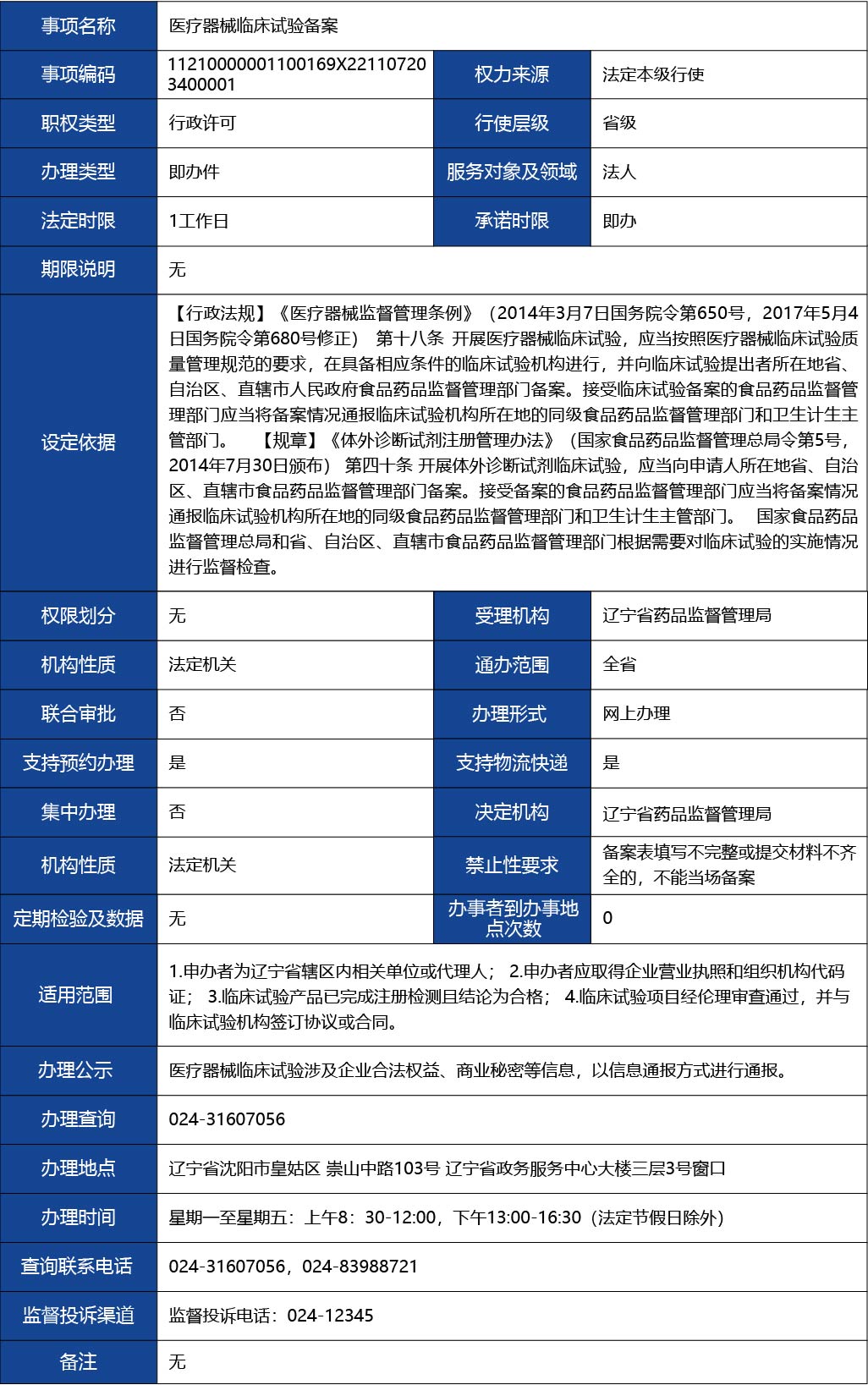
1.申辦者為遼寧省轄區(qū)內(nèi)相關單位或代理人;
2.申辦者應取得企業(yè)營業(yè)執(zhí)照和組織機構代碼證;
3.臨床試驗產(chǎn)品已完成注冊檢測且結論為合格;
4.臨床試驗項目經(jīng)倫理審查通過,并與臨床試驗機構簽訂協(xié)議或合同。
【行政法規(guī)】《醫(yī)療器械監(jiān)督管理條例》(2014年3月7日國務院令第650號,2017年5月4日國務院令第680號修正) 第十八條 開展醫(yī)療器械臨床試驗,應當按照醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范的要求,在具備相應條件的臨床試驗機構進行,并向臨床試驗提出者所在地省、自治區(qū)、直轄市人民政府食品藥品監(jiān)督管理部門備案。接受臨床試驗備案的食品藥品監(jiān)督管理部門應當將備案情況通報臨床試驗機構所在地的同級食品藥品監(jiān)督管理部門和衛(wèi)生計生主管部門。 【規(guī)章】《體外診斷試劑注冊管理辦法》(國家食品藥品監(jiān)督管理總局令第5號,2014年7月30日頒布) 第四十條 開展體外診斷試劑臨床試驗,應當向申請人所在地省、自治區(qū)、直轄市食品藥品監(jiān)督管理部門備案。接受備案的食品藥品監(jiān)督管理部門應當將備案情況通報臨床試驗機構所在地的同級食品藥品監(jiān)督管理部門和衛(wèi)生計生主管部門。 國家食品藥品監(jiān)督管理總局和省、自治區(qū)、直轄市食品藥品監(jiān)督管理部門根據(jù)需要對臨床試驗的實施情況進行監(jiān)督檢查。
不收費
《醫(yī)療器械監(jiān)督管理條例》第十三條 第一款第一類醫(yī)療器···
三類備案人應當加強醫(yī)療器械全生命周期質(zhì)量管理,對研制、···
二類《醫(yī)療器械監(jiān)督管理條例》第十三條 第一類醫(yī)療器械實行···
三類《醫(yī)療器械監(jiān)督管理條例》第十三條 第一類醫(yī)療器械實行···
三類




