
條件名稱:申請事項屬于本部門職權(quán)范圍,申報資料齊全、符合形式審查要求。
適用類型:通用
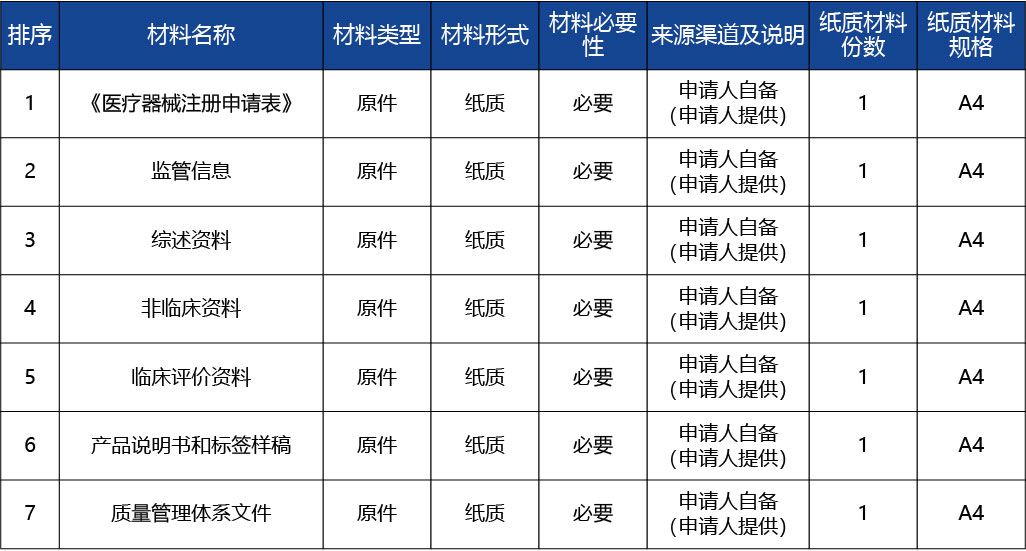
受理1
審查標(biāo)準(zhǔn):對申請人提交的申請材料不齊全或者不符合形式審查要求的,當(dāng)場告知申請人補正有關(guān)材料。
審查結(jié)果:重慶市藥品監(jiān)督管理局受理通知書
完成時限:0個工作日
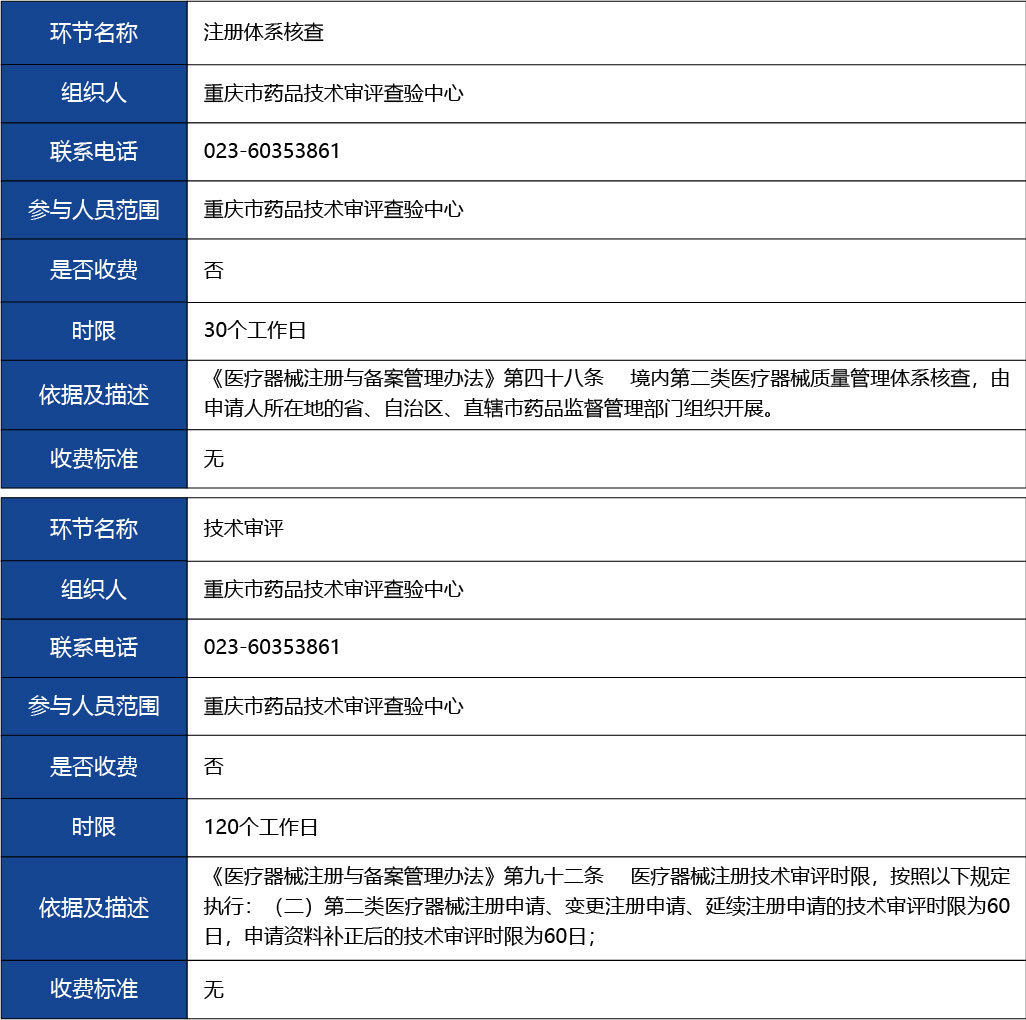
注冊體系核查2
參與人員范圍:重慶市藥品技術(shù)審評查驗中心
是否收取費用:否
時限(單位:工作日):30個工作日
依據(jù)及描述:無
收費標(biāo)準(zhǔn):無
技術(shù)審評3
參與人員范圍:重慶藥品技術(shù)審評認證中心
是否收取費用:否
時限(單位:工作日):120個工作日
依據(jù)及描述:無
收費標(biāo)準(zhǔn):無
審查4
審查標(biāo)準(zhǔn):對行政審批申請事項的合法性、合理性進行審查,對照審批條件、標(biāo)準(zhǔn),根據(jù)情況分別作出審查意見。
審查結(jié)果:醫(yī)療器械注冊處產(chǎn)品注冊資料審查意見表
完成時限:5個工作日
決定5
審查標(biāo)準(zhǔn):對行政審批申請事項的合法性、合理性進行審查,對照審批條件、標(biāo)準(zhǔn),根據(jù)情況分別作出審查決定。
審查結(jié)果:醫(yī)療器械注冊證審批表
完成時限:5個工作日
送達6
送達方式:申請人自行領(lǐng)取/郵寄
頒發(fā)證件:中華人民共和國醫(yī)療器械注冊證
辦理期限:0個工作日
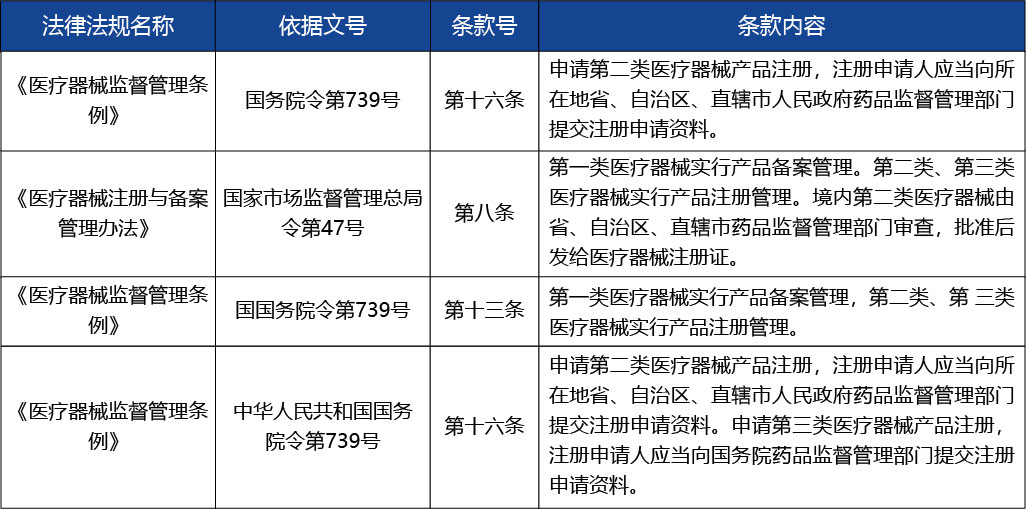

問題:1. 醫(yī)療器械注冊過程中主要法律、法規(guī)、規(guī)章制度?
解答:《醫(yī)療器械監(jiān)督管理條例》、《醫(yī)療器械注冊與備案管理辦法》、《醫(yī)療器械通用名命名規(guī)則》、《醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范》、《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》、《醫(yī)療器械說明書和標(biāo)簽管理規(guī)定》、《醫(yī)療器械注冊申報資料要求和批準(zhǔn)證明文件格式的公告》等。
問題:開展醫(yī)療器械臨床試驗有哪些規(guī)定
解答:開展醫(yī)療器械臨床試驗,應(yīng)當(dāng)按照醫(yī)療器械臨床試驗質(zhì)量管理規(guī)范的要求,在取得資質(zhì)的臨床試驗機構(gòu)內(nèi)進行。臨床試驗樣品的生產(chǎn)應(yīng)當(dāng)符合醫(yī)療器械質(zhì)量管理體系的相關(guān)要求。第三類醫(yī)療器械進行臨床試驗對人體具有較高風(fēng)險的,應(yīng)當(dāng)經(jīng)CFDA批準(zhǔn)。需進行臨床試驗審批的第三類醫(yī)療器械目錄由CFDA制定、調(diào)整并公布。臨床試驗審批是指CFDA根據(jù)申請人的申請,對擬開展臨床試驗的醫(yī)療器械的風(fēng)險程度、臨床試驗方案、臨床受益與風(fēng)險對比分析報告等進行綜合分析,以決定是否同意開展臨床試驗的過程。醫(yī)療器械臨床試驗應(yīng)當(dāng)在批準(zhǔn)后3年內(nèi)實施;逾期未實施的,原批準(zhǔn)文件自行廢止,仍需進行臨床試驗的,應(yīng)當(dāng)重新申請。
《醫(yī)療器械監(jiān)督管理條例》第十三條 第一款第一類醫(yī)療器···
三類備案人應(yīng)當(dāng)加強醫(yī)療器械全生命周期質(zhì)量管理,對研制、···
二類《醫(yī)療器械監(jiān)督管理條例》第十三條 第一類醫(yī)療器械實行···
三類《醫(yī)療器械監(jiān)督管理條例》第十三條 第一類醫(yī)療器械實行···
三類




