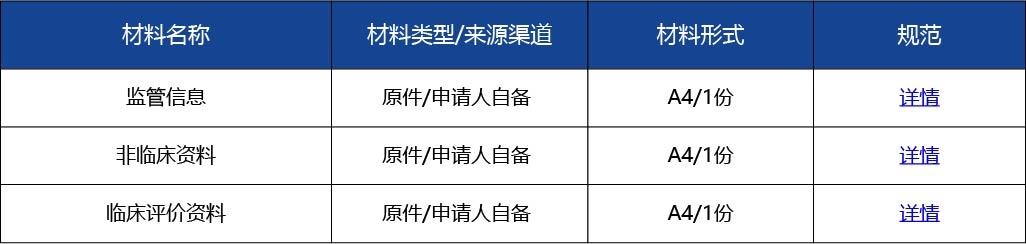
如何準備臨床評價資料?
答: 行政相對人可參考《國家藥監(jiān)局關于發(fā)布醫(yī)療器械臨床評價技術指導原則等5項技術指導原則的通告》(2021年第73號)準備臨床評價資料。

如何準備臨床評價資料?
答: 行政相對人可參考《國家藥監(jiān)局關于發(fā)布醫(yī)療器械臨床評價技術指導原則等5項技術指導原則的通告》(2021年第73號)準備臨床評價資料。

申請人申請
國家藥品監(jiān)督管理局受理/不予受理
技術審評機構審評通過/不予通過(必要時,組織開展質量管理體系核查;對于擬作出不通過的審評結論的,申請人可以提出異議)
國家藥品監(jiān)督管理局準予延續(xù)/不予延續(xù)(必要時,開展現(xiàn)場勘驗或組織聽證)
送達
《醫(yī)療器械監(jiān)督管理條例》第十三條 第一類醫(yī)療器械實行產(chǎn)品備案管理,第二類、第三類醫(yī)療器械實行產(chǎn)品注冊管理。 醫(yī)療器械注冊人、備案人應當加強醫(yī)療器械全生命周期質量管理,對研制、生產(chǎn)、經(jīng)營、使用全過程中醫(yī)療器械的安全性、有效性依法承擔責任。

《醫(yī)療器械監(jiān)督管理條例》第十三條 第一款第一類醫(yī)療器···
三類備案人應當加強醫(yī)療器械全生命周期質量管理,對研制、···
二類《醫(yī)療器械監(jiān)督管理條例》第十三條 第一類醫(yī)療器械實行···
三類《醫(yī)療器械監(jiān)督管理條例》第十三條 第一類醫(yī)療器械實行···
三類




